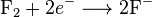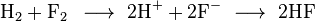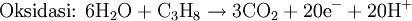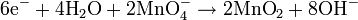Oleh Andy Adom
Reaksi Redoks adalah reaksi yang didalamnya terjadi perpindahan elektron secara berurutan dari satu spesies kimia ke spesies kimia lainnya, yang sesungguhnya terdiri atas dua reaksi yang berbeda, yaitu oksidasi (kehilangan elektron) dan reduksi (memperoleh elektron). Reaksi ini merupakan pasangan, sebab elektron yang hilang pada reaksi oksidasi sama dengan elektron yang diperoleh pada reaksi reduksi. Masing-masing reaksi (oksidasi dan reduksi) disebut reaksi paruh (setengah reaksi), sebab diperlukan duasetengah reaksi ini untuk membentuk sebuah reaksi dan reaksi keseluruhannya disebut reaksi redoks.
Oksidasi adalah reaksi dimana suatu senyawa kimia kehilangan elektron selama perubahan dari reaktan menjadi produk. Sebagai contoh, ketika logam Kalium bereaksi dengan gas Klorin membentuk garam Kalium Klorida (KCl), logam Kalium kehilangan satu elektron yang kemudian akan digunakan oleh klorin. Reaksi yang terjadi adalah sebagai berikut :
K —–> K+ + e-
Ketika Kalium kehilangan elektron, para kimiawan mengatakan bahwa logam Kalium itu telah teroksidasi menjadi kation Kalium.
Reduksi sering dilihat sebagai proses memperoleh elektron. Sebagai contoh, pada proses penyepuhan perak pada perabot rumah tangga, kation perak direduksi menjadi logam perak dengan cara memperoleh elektron. Reaksi yang terjadi adalah sebagai berikut :
Ag+ + e- ——> Ag
Ketika mendapatkan elektron, para kimiawan mengatakan bahwa kation perak telah tereduksi menjadi logam perak.
Baik oksidasi maupun reduksi tidak dapat terjadi sendiri, harus keduanya. Ketika elektron tersebut hilang, sesuatu harus mendapatkannya. Sebagai contoh, reaksi yang terjadi antara logam seng dengan larutan tembaga (II) sulfat dapat dinyatakan dalam persamaan reaksi berikut :
Zn(s) + CuSO4(aq) ——> ZnSO4(aq) + Cu(s)
Zn(s) + Cu2+(aq) ——> Zn2+(aq) + Cu(s) (persamaan ion bersih)
Logam seng kehilangan dua elektron, sedangkan kation tembaga (II) mendapatkan dua elektron yang sama. Logam seng teroksidasi. Tetapi, tanpa adanya kation tembaga (II), tidak akan terjadi suatu apa pun. Kation tembaga (II) disebut zat pengoksidasi (oksidator). Oksidator menerima elektron yang berasal dari spesies kimia yang telah teroksidasi.
Sementara kation tembaga (II) tereduksi karena mendapatkan elektron. Spesies yang memberikan elektron disebut zat pereduksi (reduktor). Dalam hal ini, reduktornya adalah logam seng. Dengan demikian, oksidator adalah spesies yang tereduksi danreduktor adalah spesies yang teroksidasi. Baik oksidatormaupun reduktor berada di ruas kiri (reaktan) persamaan redoks.
Elektrokimia adalah salah satu dari cabang ilmu kimia yang mengkaji tentang perubahan bentuk energi listrik menjadi energi kimia dan sebaliknya. Proses elektrokimia melibatkan reaksi redoks. Proses transfer elektron akan menghasilkan sejumlah energi listrik. Aplikasi elektrokimia dapat diterapkan dalam dua jenis sel, yaitu sel volta dan sel elektrolisis. Sebelum membahas kedua jenis sel tersebut, kita terlebih dahulu akan mempelajari metode penyetaraan reaksi redoks.
Persamaan reaksi redoks biasanya sangat kompleks, sehingga metode penyeteraan reaksi kimia biasa tidak dapat diterapkan dengan baik. Dengan demikian, para kimiawan mengembangkan dua metode untuk menyetarakan persamaan redoks. Salah satu metode disebut metode perubahan bilangan oksidasi (PBO), yang berdasarkan pada perubahan bilangan oksidasi yang terjadi selama reaksi. Metode lain, disebut metode setengah reaksi (metode ion-elektron). Metode ini melibatkan dua buah reaksi paruh, yang kemudian digabungkan menjadi reaksi redoks keseluruhan.
Berikut ini penjelasan sekilas tentang metode setengah reaksi :persamaan redoks yang belum setara diubah menjadi persamaan ion dan kemudian dipecah menjadi dua reaksi paruh, yaitu reaksi oksidasi dan reaksi reduksi; setiap reaksi paruh ini disetarakan dengan terpisah dan kemudian digabungkan untuk menghasilkan ion yang telah disetarakan; akhirnya, ion-ion pengamat kembali dimasukkan ke persamaan ion yang telah disetarakan, mengubah reaksi menjadi bentuk molekulnya.
Sebagai contoh, saya akan menjelaskan langkah-langkah untuk menyetarakan persamaan redoks berikut :
Fe2+(aq) + Cr2O72-(aq) ——> Fe3+(aq) + Cr3+(aq)
1. Menuliskan persamaan reaksi keseluruhan
Fe2+ + Cr2O72- ——> Fe3+ + Cr3+
2. Membagi reaksi menjadi dua reaksi paruh
Fe2+ ——> Fe3+
Cr2O72- ——> Cr3+
3. Menyetarakan jenis atom dan jumlah atom dan muatan pada masing-masing setengah reaksi; dalam suasana asam, tambahkan H2O untuk menyetarakan atom O dan H+ untuk menyetarakan atom H
Fe2+ ——> Fe3+ + e-
6 e- + 14 H+ + Cr2O72- ——> 2 Cr3+ + 7 H2O
4. Menjumlahkan kedua setengah reaksi; elektron pada kedua sisi harus saling meniadakan; jika oksidasi dan reduksi memiliki jumlah elektron yang berbeda, maka harus disamakan terlebih dahulu
6 Fe2+ ——> 6 Fe3+ + 6 e- ……………… (1)
6 e- + 14 H+ + Cr2O72- ——> 2 Cr3+ + 7 H2O ……………… (2)
6 Fe2+ + 14 H+ + Cr2O72- ——> 6 Fe3+ + 2 Cr3+ + 7 H2O ………………… [(1) + (2)]
5. Mengecek kembali dan yakin bahwa kedua ruas memiliki jenis atom dan jumlah atom yang sama, serta memiliki muatan yang sama pada kedua ruas persamaan reaksi
Untuk reaksi yang berlangsung dalam suasana basa, tambahkan ion OH- dalam jumlah yang sama dengan ion H+ pada masing-masing ruas untuk menghilangkan ion H+. Persamaan reaksi tersebut berubah menjadi sebagai berikut :
6 Fe2+ + 14 H+ + 14 OH- + Cr2O72- ——> 6 Fe3+ + 2 Cr3+ + 7 H2O + 14 OH-
6 Fe2+ + 14 H2O + Cr2O72- ——> 6 Fe3+ + 2 Cr3+ + 7 H2O + 14 OH-
6 Fe2+ + 7 H2O + Cr2O72- ——> 6 Fe3+ + 2 Cr3+ + 14 OH-
Berikut ini adalah contoh lain penyelesaian penyetaraan persamaan reaksi redoks :
Cu(s) + HNO3(aq) ——> Cu(NO3)2(aq) + NO(g) + H2O(l)
1. Mengubah reaksi redoks yang belum disetarakan menjadi bentuk ion
Cu + H+ + NO3- ——> Cu2+ + 2 NO3- + NO + H2O
2. Menentukan bilangan oksidasi dan menuliskan dua setengah reaksi (oksidasi dan reduksi) yang menunjukkan spesies kimia yang telah mengalami perubahan bilangan oksidasi
Cu ——> Cu2+
NO3- ——> NO
3. Menyetarakan semua atom, dengan pengecualian untuk oksigen dan hidrogen
Cu ——> Cu2+
NO3- ——> NO
4. Menyetarakan atom oksigen dengan menambahkan H2O pada ruas yang kekurangan oksigen
Cu ——> Cu2+
NO3- ——> NO + 2 H2O
5. Menyetarakan atom hidrogen dengan menambahkan H+ pada ruas yang kekurangan hidrogen
Cu ——> Cu2+
4 H+ + NO3- ——> NO + 2 H2O
6. Menyetarakan muatan ion pada setiap ruas setengah reaksidengan menambahkan elektron
Cu ——> Cu2+ + 2 e-
3 e- + 4 H+ + NO3- ——> NO + 2 H2O
7. Menyetarakan kehilangan elektron dengan perolehan elektron antara kedua setengah reaksi
3 Cu ——> 3 Cu2+ + 6 e-
6 e- + 8 H+ + 2 NO3- ——> 2 NO + 4 H2O
8. Menggabungkan kedua reaksi paruh tersebut dan menghilangkan spesi yang sama di kedua sisi; elektron selalu harus dihilangkan (jumlah elektron di kedua sisi harus sama)
3 Cu ——> 3 Cu2+ + 6 e- …………………….. (1)
6 e- + 8 H+ + 2 NO3 ——> 2 NO + 4 H2O …………………….. (2)
3 Cu + 8 H+ + 2 NO3- ——> 3 Cu2+ + 2 NO + 4 H2O …………………………….. [(1) + (2)]
9. Mengubah persamaan reaksi kembali ke bentuk molekulnya dengan menambahkan ion pengamat
3 Cu + 8 H+ + 2 NO3- + 6 NO3- ——> 3 Cu2+ + 2 NO + 4 H2O + 6 NO3-
3 Cu + 8 HNO3 ——> 3 Cu(NO3)2 + 2 NO + 4 H2O
10. Memeriksa kembali untuk meyakinkan bahwa semua atomnya telah setara, semua muatannya telah setara, dan semua koefisiennya ada dalam bentuk bilangan bulat terkecil
Metode lain yang digunakan dalam menyetarakan persamaan reaksi redoks adalah metode perubahan bilangan oksidasi (PBO). Saya akan menjelaskan langkah-langkah penyetaraan reaksi redoks dengan metode PBO melalu contoh berikut :
MnO4-(aq) + C2O42-(aq) ——> Mn2+(aq) + CO2(g)
1. Menentukan bilangan oksidasi masing-masing unsur
MnO4- + C2O42- ——> Mn2+ + CO2
+7 -2 +3 -2 +2 +4 -2
2. Menentukan unsur yang mengalami perubahan bilangan oksidasi serta besarnya perubahan bilangan oksidasi
Mn mengalami perubahan bilangan oksidasi dari +7 menjadi +2; besarnya perubahan bilangan oksidasi (Δ) sebesar 5
C mengalami perubahan bilangan oksidasi dari +3 menjadi +4; besarnya perubahan bilangan okisdasi (Δ) sebesar 1
3. Mengalikan perubahan bilangan oksidasi (Δ) dengan jumlah atom yang mengalami perubahan bilangan oksidasi
Mn : Δ = 5 x 1 = 5
C : Δ = 1 x 2 = 2
4. Menyamakan jumlah atom yang mengalami perubahan bilangan oksidasi pada masing-masing ruas
MnO4- + C2O42- ——> Mn2+ + 2 CO2
5. Menyamakan perubahan bilangan oksidasi (Δ); bilangan pengali dijadikan sebagai koefisien reaksi baru
Mn dikalikan 2 dan C dikalikan 5, sehingga Δ kedua unsur sama, yaitu sebesar 10
2 MnO4- + 5 C2O42- ——> 2 Mn2+ + 10 CO2
6. Dalam tahap ini, reaksi hampir selesai disetarakan; selanjutnya atom O dapat disetarakan dengan menambahkan H2O pada ruas yang kekurangan atom O; sementara untuk menyetarakan atom H, gunakan H+
16 H+ + 2 MnO4- + 5 C2O42- ——> 2 Mn2+ + 10 CO2 + 8 H2O
7. Memeriksa kembali untuk meyakinkan bahwa semua atomnya telah setara, semua muatannya telah setara, dan semua koefisiennya ada dalam bentuk bilangan bulat terkecil
Untuk reaksi yang berlangsung dalam suasana basa, tambahkan ion OH- dalam jumlah yang sama dengan ion H+ pada masing-masing ruas untuk menghilangkan ion H+. Persamaan reaksi tersebut berubah menjadi sebagai berikut :
16 OH- + 16 H+ + 2 MnO4- + 5 C2O42- ——> 2 Mn2+ + 10 CO2+ 8 H2O + 16 OH-
16 H2O + 2 MnO4- + 5 C2O42- ——> 2 Mn2+ + 10 CO2 + 8 H2O + 16 OH-
8 H2O + 2 MnO4- + 5 C2O42- ——> 2 Mn2+ + 10 CO2 + 16 OH-
Selanjutnya, saya akan kembali memberikan sebuah contoh penyelesaian persamaan reaksi redoks dengan metode PBO :
MnO(s) + PbO2(s) + HNO3(aq) ——> HMnO4(aq) + Pb(NO3)2(aq) + H2O(l)
1. Mengubah reaksi redoks yang belum disetarakan menjadi bentuk ion
MnO + PbO2 + H+ + NO3‑ ——> H+ + MnO4- + Pb2+ + 2 NO3- + H2O
2. Menentukan bilangan oksidasi masing-masing unsur
MnO + PbO2 + H+ + NO3‑ ——> H+ + MnO4- + Pb2+ + 2 NO3- + H2O
+2 -2 +4 -2 + 1 +5 -2 +1 +7 -2 +2 +5 -2 +1 -2
3. Menuliskan kembali semua unsur yang mengalami perubahan bilangan oksidasi; ion pengamat tidak disertakan
MnO + PbO2 ——> MnO4- + Pb2+
+2 -2 +4 -2 +7 -2 +2
4. Menentukan unsur yang mengalami perubahan bilangan oksidasi serta besarnya perubahan bilangan oksidasi
Mn mengalami perubahan bilangan oksidasi dari +2 menjadi +7; besarnya perubahan bilangan oksidasi (Δ) sebesar 5
Pb mengalami perubahan bilangan oksidasi dari +4 menjadi +2; besarnya perubahan bilangan okisdasi (Δ) sebesar 2
5. Mengalikan perubahan bilangan oksidasi (Δ) dengan jumlah atom yang mengalami perubahan bilangan oksidasi
Mn : Δ = 5 x 1 = 5
Pb : Δ = 2 x 1 = 2
6. Menyamakan jumlah atom yang mengalami perubahan bilangan oksidasi pada masing-masing ruas
MnO + PbO2 ——> MnO4- + Pb2+
7. Menyamakan perubahan bilangan oksidasi (Δ); bilangan pengali dijadikan sebagai koefisien reaksi baru
Mn dikalikan 2 dan Pb dikalikan 5, sehingga Δ kedua unsur sama, yaitu sebesar 10
2 MnO + 5 PbO2 ——> 2 MnO4- + 5 Pb2+
8. Dalam tahap ini, reaksi hampir selesai disetarakan; selanjutnya atom O dapat disetarakan dengan menambahkan H2O pada ruas yang kekurangan atom O; sementara untuk menyetarakan atom H, gunakan H+
8 H+ + 2 MnO + 5 PbO2 ——> 2 MnO4- + 5 Pb2+ + 4 H2O
9. Mengubah persamaan reaksi kembali ke be ntuk molekulnya dengan menambahkan ion pengamat
10 NO3- + 2 H+ + 8 H+ + 2 MnO + 5 PbO2 ——> 2 MnO4- + 5 Pb2+ + 4 H2O + 2 H+ + 10 NO3-
2 MnO + 5 PbO2 + 10 HNO3 ——> 2 HMnO4 + 5 Pb(NO3)2 + 4 H2O
10. Memeriksa kembali untuk meyakinkan bahwa semua atomnya telah setara, semua muatannya telah setara, dan semua koefisiennya ada dalam bentuk bilangan bulat terkecil
Pada pembahasan sebelumnya, kita telah mengetahui bahwa saat sepotong logam seng dicelupkan ke dalam larutan tembaga (II) sulfat, akan terjadi reaksi redoks. Logam seng akan teroksidasi menjadi ion Zn2+, sementara ion Cu2+ akan tereduksi menjadi logam tembaga yang menutupi permukaan logam seng. Persamaan untuk reaksi ini adalah sebagai berikut :
Zn(s) + Cu2+(aq) ——> Zn2+(aq) + Cu(s)
Ini merupakan contoh perpindahan elektron langsung. Logam seng memberikan dua elektron (menjadi teroksidasi) ke ion Cu2+ yang menerima kedua elektron tersebut (mereduksinya menjadi logam tembaga). Logam tembaga akan melapisi permukaan logam seng.
Seandainya kedua reaksi paruh tersebut dapat dipisahkan, sehingga ketika logam seng teroksidasi, elektron akan dilepaskan dan dialirkan melalui kawat penghantar untuk mencapai ion Cu2+(perpindahan elektron tidak langsung), kita akan mendapatkan sesuatu yang bermanfaat. Selama reaksi kimia berlangsung, akan terjadi aliran elektron yang menghasilkan energi listrik. Peralatan yang dapat mengubah energi kimia (reaksi redoks) menjadi arus listrik (aliran elektron = energi listrik) dikenal dengan Sel Voltaatau Sel Galvani.
Salah satu contoh sel volta yang sering digunakan para kimiawan adalah Sel Daniell. Sel volta ini menggunakan reaksi antara logam Zn dan ion Cu2+ untuk menghasilkan listrik. Sel Daniell diberi nama menurut penemunya, John Frederic Daniell, seorang kimiawan Inggris yang menemukannya pada tahun 1836).
Pada Sel Daniell, sepotong logam seng dimasukkan ke dalam larutan seng (II) sulfat, ZnSO4(aq), pada satu wadah. Sementara, sepotong logam tembaga juga dimasukkan ke dalam larutan tembaga (II) sulfat, CuSO4(aq), pada wadah lainnya. Potongan logam tersebut disebut elektroda yang berfungsi sebagai ujung akhir atau penampung elektron. Kawat penghantar akan menghubungkan elektroda-elektrodanya. Selanjutnya, rangkaian sel dilengkapi pula dengan jembatan garam. Jembatan garam, biasanya berupa tabung berbentuk U yang terisi penuh dengan larutan garam pekat, memberikan jalan bagi ion untuk bergerak dari satu tempat ke tempat lainnya untuk menjaga larutan agar muatan listriknya tetap netral.
Sel Daniell bekerja atas dasar prinsip reaksi redoks. Logam sengteroksidasi dan membebaskan elektron yang mengalir melalui kawat menuju elektroda tembaga. Selanjutnya, elektron tersebut digunakan oleh ion Cu2+ yang mengalami reduksi membentuk logam tembaga. Ion Cu2+ dari larutan tembaga (II) sulfat akan melapisi elektroda tembaga, sedangkan elektroda seng semakin berkurang (habis). Kation-kation di dalam jembatan garam berpindah ke wadah yang mengandung elektroda tembaga untuk menggantikan ion tembaga yang semakin habis. Sebaliknya, anion-anion padajembatan garam berpindah ke sisi elektroda seng, yang menjaga agar larutan yang mengandung ion Zn2+ tetap bermuatan listrik netral.
Elektroda seng disebut anoda, yaitu elektroda yang menjadi tempat terjadinya reaksi oksidasi. Oleh karena anoda melepaskan elektron, maka anoda kaya akan elektron sehingga diberi tandanegatif (kutub negatif). Sementara, elektroda tembaga disebutkatoda, yaitu elektroda yang menjadi tempat terjadinya reaksireduksi. Oleh karena katoda menerima elektron, maka katodakekurangan elektron sehingga diberi tanda positif (kutub positif).
Reaksi yang terjadi pada masing-masing elektroda (reaksi setengah sel) adalah sebagai berikut :
Anoda (-) : Zn(s) ——> Zn2+(aq) + 2e- ……………………. (1)
Katoda (+) : Cu2+(aq) + 2e- ——> Cu(s) ……………………. (2)
Reaksi Sel : Zn(s) + Cu2+(aq) ——> Zn2+(aq) + Cu(s)…………………………… [(1) + (2)]
Munculnya arus listrik (aliran elektron) yang terjadi dari anodamenuju katoda disebabkan oleh perbedaan potensial elektrikantara kedua elektroda tersebut. Melalui percobaan, perbedaan potensial elektrik antara katoda dan anoda dapat diukur denganvoltmeter dan hasilnya berupa potensial standar sel (E°sel). Semakin besar perbedaan potensial elektrik, semakin besar pulaarus listrik dan potensial standar sel yang dihasilkan.
Reaksi yang terjadi pada sel volta dapat dinyatakan dalam bentuk yang lebih ringkas, yaitu notasi sel. Sesuai dengan kesepakatan, reaksi oksidasi dinyatakan di sisi kiri, sementara reaksi reduksidinyatakan di sisi kanan. Notasi sel untuk Sel Daniell adalah sebagai berikut :
Zn(s) / Zn2+(aq) // Cu2+(aq) / Cu(s)
Saat konsentrasi ion Cu2+ dan Zn2+ masing-masing 1 M, terlihat pada voltmeter bahwa besarnya potensial standar sel (E°sel)bagi Sel Daniell adalah 1,10 V pada suhu 25°C. Oleh karena reaksi sel merupakan hasil penjumlahan dari dua reaksi setengah sel, maka potensial standar sel merupakan hasil penjumlahan dari duapotensial standar setengah sel. Pada Sel Daniell, potensial standar sel merupakan hasil penjumlahan potensial elektroda Cu dan Zn. Dengan mengetahui potensial standar dari masing-masing elektroda, kita dapat menentukan besarnya potensial standar sellain yang terbentuk. Potensial yang digunakan dalam pemahasan ini adalah potensial standar reduksi.
Potensial standar reduksi masing-masing elektroda dapat ditentukan dengan membandingkannya terhadap elektroda standar (acuan), yaitu elektroda hidrogen standar (SHE = Standard Hydrogen Electrode). Keadaan standar yang dimaksud adalah saat tekanan gas H2 sebesar 1 atm, konsentrasi larutan ion H+sebesar 1 M, dan dan pengukuran dilakukan pada suhu 25°C. Sesuai dengan kesepakatan, SHE memiliki potensial standar reduksi sebesar nol (E°red SHE = 0).
2 H+ (1 M) + 2 e- ——> H2 (1 atm) E°red = 0 V
SHE dapat digunakan untuk menentukan besarnya potensial standar reduksi (E°red) elektroda lainnya. Dengan demikian, kita dapat menyusun suatu daftar yang berisi urutan nilai E°redelektroda-elektroda, dari yang terkecil (paling negatif) hingga yang terbesar (paling positif). Susunan elektroda-elektroda tersebut di kenal dengan istilah Deret Volta (deret kereaktifan logam).
Li – K – Ba – Sr – Ca – Na – Mg – Al – Mn – Zn – Cr – Fe – Cd – Co – Ni – Sn – Pb – H+ – Cu – Ag – Hg – Pt – Au
Logam-logam yang terletak di sisi kiri H+ memiliki E°red bertandanegatif. Semakin ke kiri, nilai E°red semakin kecil (semakin negatif). Hal ini menandakan bahwa logam-logam tersebut semakin sulit mengalami reduksi dan cenderung mengalami oksidasi. Oleh sebab itu, kekuatan reduktor akan meningkat dari kanan ke kiri. Sebaliknya, logam-logam yang terletak di sisi kanan H+ memiliki E°red bertanda positif. Semakin ke kanan, nilai E°red semakin besar (semakin positif). Hal ini berarti bahwa logam-logam tersebut semakin mudah mengalami reduksi dan sulit mengalami oksidasi. Oleh sebab itu, kekuatan oksidator akan meningkat dari kiri ke kanan. Singkat kata, logam yang terletak disebelah kanan relatif terhadap logam lainnya, akan mengalami reduksi. Sementara, logam yang terletak di sebelah kiri relatif terhadap logam lainnya, akan mengalami oksidasi. Logam yang terletak disebelah kiri relatif terhadap logam lainnya mampu mereduksi ion logam menjadi logam (mendesak ion dari larutannya menjadi logam). Sebaliknya, logam yang terletak di sebelah kanan relatif terhadap logam lainnya mampu mengoksidasi logam menjadi ion logam (melarutkan logam menjadi ion dalam larutannya).
Sebagai contoh, kita ingin merangkai sebuah sel volta dengan menggunakan elektroda Fe dan Ni. Berdasarkan susunan logam pada deret volta, logam Fe terletak di sebelah kiri relatif terhadap logam Ni. Hal ini menandakan bahwa logam Ni lebih mudah tereduksi dibandingkan logam Fe. Akibatnya, dalam sel volta, elektroda Ni berfungsi sebagai katoda, sedangkan elektroda Fe berfungsi sebagai anoda. Reaksi yang terjadi pada sel voltaadalah sebagai berikut :
Katoda (+) : Ni2+ + 2 e- ——> Ni ……………………. (1)
Anoda (-) : Fe ——> Fe2+ + 2 e- ……………………. (2)
Reaksi Sel : Fe + Ni2+ ——> Fe2+ + Ni …………………………………… [(1) + (2)]
Notasi Sel : Fe / Fe2+ // Ni2+ / Ni
Sesuai dengan kesepakatan, potensial sel (E°sel) merupakan kombinasi dari E°red katoda dan E°red anoda, yang ditunjukkan melalui persamaan berikut :
E°sel = E° katoda – E° anoda
Potensial reduksi standar (E°red) masing-masing elektroda dapat dilihat pada Tabel Potensial Standar Reduksi. Dari tabel, terlihat bahwa nilai E°red Fe adalah sebesar -0,44 V. Sementara nilai E°red Ni adalah sebesar -0,25 V. Dengan demikian, nilai E°selFe/Ni adalah sebagai berikut :
E°sel = -0,25 – (-0,44) = +0,19 V
Suatu reaksi redoks dapat berlangsung spontan apabila nilai E°sel positif. Reaksi tidak dapat berlangsung spontan apabila nilai E°sel negatif. Reaksi yang dapat berlangsung spontan justru adalah reaksi kebalikannya.
Apabila larutan tidak dalam keadaan standar, maka hubungan antara potensial sel (Esel) dengan potensial sel standar (E°sel)dapat dinyatakan dalam persamaan Nerst berikut ini :
E sel = E°sel – (RT/nF) ln Q
Pada suhu 298 K (25°C), persamaan Nerst berubah menjadi sebagai berikut :
E sel = E°sel – (0,0257/n) ln Q
E sel = E°sel – (0,0592/n) log Q
Esel = potensial sel pada keadaan tidak standar
E°sel = potensial sel pada keadaan standar
R = konstanta gas ideal = 8,314 J/mol.K
T = suhu mutlak (K) [dalam hal ini, kita menggunakan temperatur kamar, 25°C atau 298 K]
n = jumlah mol elektron yang terlibat dalam redoks
F = konstanta Faraday = 96500 C/F
Q = rasio konsentrasi ion produk terhadap konsentrasi ion reaktan
Selama proses reaksi redoks berlangsung, elektron akan mengalir dari anoda menuju katoda. Akibatnya, konsentrasi ion reaktan akan berkurang, sebaliknya konsentrasi ion produk akan bertambah. Nilai Q akan meningkat, yang menandakan bahwa nilai Esel akan menurun. Pada saat reaksi mencapai kesetimbangan, aliran elektron akan terhenti. Akibatnya, Esel = 0 dan Q = K (K= konstanta kesetimbangan kimia). Dengan demikian, konstanta kesetimbangan kimia (K) dapat ditentukan melalui sel volta.
Melalui pembahasan persamaan Nerst, dapat terlihat bahwa besarnya potensial sel dipengaruhi oleh konsentrasi. Dengan demikian, kita dapat merakit sel volta yang tersusun dari dua elektroda yang identik, tetapi masing-masing memiliki konsentrasi ion yang berbeda. Sel seperti ini dikenal dengan istilah Sel Konsentrasi.
Sebagai contoh, sel konsentrasi dengan elektroda Zn, masing-masing memiliki konsentrasi ion seng sebesar 1,0 M dan 0,1 M.Larutan yang relatif pekat akan mengalami reduksi, sementara larutan yang lebih encer mengalami oksidasi.Potensial standar sel (E°sel) untuk sel konsentrasi adalah nol (0). Reaksi yang terjadi pada sel konsentrasi Zn adalah sebagai berikut :
Katoda (+) : Zn2+ (1,0 M) + 2 e- ——> Zn …………………….. (1)
Anoda (-) : Zn ——> Zn2+ (0,1 M) + 2 e‑…………………….. (2)
Reaksi Sel : Zn2+ (1,0 M) ——> Zn2+ (0,1 M) …………………………….. [(1) + (2)]
Notasi Sel : Zn / Zn2+ (0,1 M) // Zn2+ (1,0 M) / Zn
Potensial sel konsentrasi dapat diperoleh melalui persamaan Nerst berikut :
E sel = E°sel – (0,0257/2) ln ([Zn2+] encer / [Zn2+] pekat)
E sel = 0 – (0,0257/2) ln [(0,1] / [1,0])
E sel = 0,0296 volt
Potensial sel konsentrasi umumnya relatif kecil dan semakin berkurang selama proses reaksi berlangsung. Reaksi akan terus berlangsung hingga kedua wadah mencapai keadaan konsentrasi ion sama. Apabila konsentrasi ion kedua wadah telah sama, Esel = 0dan aliran elektron terhenti.
Aplikasi pengetahuan sel volta dapat ditemukan dalam kehidupan sehari-hari. Salah satu contoh aplikasi sel volta adalah penggunaan batu baterai. Baterai adalah sel galvani, atau gabungan dari beberapa sel galvani , yang dapat digunakan sebagai sumber arus listrik.