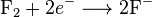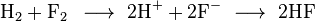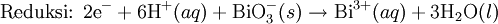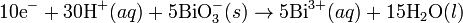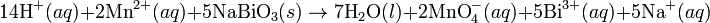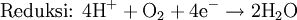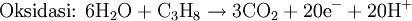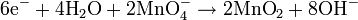Ilustrasi sebuah reaksi redoks
Redoks (singkatan dari reaksi
reduksi/oksidasi) adalah istilah yang menjelaskan berubahnya
bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah
reaksi kimia.
Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi
karbon yang menghasilkan
karbon dioksida, atau reduksi
karbon oleh
hidrogen menghasilkan
metana(CH
4), ataupun ia dapat berupa proses yang kompleks seperti oksidasi
gula pada tubuh manusia melalui rentetan
transfer elektron yang rumit.
Istilah
redoks berasal dari dua konsep, yaitu
reduksi dan
oksidasi. Ia dapat dijelaskan dengan mudah sebagai berikut:
Walaupun cukup tepat untuk digunakan dalam berbagai tujuan, penjelasan di atas tidaklah persis benar. Oksidasi dan reduksi tepatnya merujuk pada
perubahan bilangan oksidasi karena transfer elektron yang sebenarnya tidak akan selalu terjadi. Sehingga oksidasi lebih baik didefinisikan sebagai
peningkatan bilangan oksidasi, dan reduksi sebagai
penurunan bilangan oksidasi. Dalam prakteknya, transfer elektron akan selalu mengubah bilangan oksidasi, namun terdapat banyak reaksi yang diklasifikasikan sebagai "redoks" walaupun tidak ada transfer elektron dalam reaksi tersebut (misalnya yang melibatkan ikatan
kovalen).
Reaksi non-redoks yang tidak melibatkan perubahan
muatan formal (
formal charge) dikenal sebagai
reaksi metatesis.

Dua bagian dalam sebuah reaksi redoks

Pembakaran terdiri dari reaksi redoks yang melibatkan
radikal bebas Oksidator dan reduktor Senyawa-senyawa yang memiliki kemampuan untuk meng
oksidasi senyawa lain dikatakan sebagai
oksidatif dan dikenal sebagai
oksidator atau
agen oksidasi. Oksidator melepaskan elektron dari senyawa lain, sehingga dirinya sendiri tereduksi. Oleh karena ia "menerima" elektron, ia juga disebut sebagai
penerima elektron. Oksidator bisanya adalah senyawa-senyawa yang memiliki unsur-unsur dengan bilangan oksidasi yang tinggi (seperti
H2O2,
MnO4−,
CrO3, Cr
2O
72−,
OsO4) atau senyawa-senyawa yang sangat
elektronegatif, sehingga dapat mendapatkan satu atau dua elektron yang lebih dengan mengoksidasi sebuah senyawa (misalnya
oksigen,
fluorin,
klorin, dan
bromin).
Senyawa-senyawa yang memiliki kemampuan untuk me
reduksi senyawa lain dikatakan sebagai
reduktif dan dikenal sebagai
reduktor atau
agen reduksi. Reduktor melepaskan elektronnya ke senyawa lain, sehingga ia sendiri teroksidasi. Oleh karena ia "mendonorkan" elektronnya, ia juga disebut sebagai
penderma elektron. Senyawa-senyawa yang berupa reduktor sangat bervariasi. Unsur-unsur
logam seperti Li, Na, Mg, Fe, Zn, dan Al dapat digunakan sebagai reduktor. Logam-logam ini akan
memberikan elektronnya dengan mudah. Reduktor jenus lainnya adalah
reagen transfer hidrida, misalnya NaBH
4 dan LiAlH
4), reagen-reagen ini digunakan dengan luas dalam
kimia organik, terutama dalam reduksi senyawa-senyawa
karbonil menjadi
alkohol. Metode reduksi lainnya yang juga berguna melibatkan gas hidrogen (H
2) dengan
katalis paladium,
platinum, atau
nikel,
Reduksi katalitik ini utamanya digunakan pada reduksi ikatan rangkap dua ata tiga karbon-karbon.
Cara yang mudah untuk melihat proses redoks adalah, reduktor mentransfer elektronnya ke oksidator. Sehingga dalam reaksi, reduktor melepaskan elektron dan teroksidasi, dan oksidator mendapatkan elektron dan tereduksi. Pasangan oksidator dan reduktor yang terlibat dalam sebuah reaksi disebut sebagai
pasangan redoks.
Contoh reaksi redoks
Salah satu contoh reaksi redoks adalah antara
hidrogen dan
fluorin:

Kita dapat menulis keseluruhan reaksi ini sebagai dua reaksi setengah: reaksi oksidasi

dan reaksi reduksi
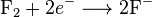
Penganalisaan masing-masing reaksi setengah akan menjadikan keseluruhan proses kimia lebih jelas. Karena tidak terdapat perbuahan total muatan selama reaksi redoks, jumlah elektron yang berlebihan pada reaksi oksidasi haruslah sama dengan jumlah yang dikonsumsi pada reaksi reduksi.
Unsur-unsur, bahkan dalam bentuk molekul, sering kali memiliki bilangan oksidasi nol. Pada reaksi di atas, hidrogen teroksidasi dari bilangan oksidasi 0 menjadi +1, sedangkan fluorin tereduksi dari bilangan oksidasi 0 menjadi -1.
Ketika reaksi oksidasi dan reduksi digabungkan, elektron-elektron yang terlibat akan saling mengurangi:

Dan ion-ion akan bergabung membentuk
hidrogen fluorida:
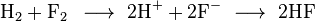 Reaksi penggantian
Reaksi penggantian
Redoks terjadi pada
reaksi penggantian tunggal atau
reaksi substitusi. Komponen redoks dalam tipe reaksi ini ada pada perubahan keadaan oksidasi (muatan) pada atom-atom tertentu, dan bukanlah pada pergantian atom dalam senyawa.
Sebagai contoh, reaksi antara larutan besi dan tembaga(II) sulfat:

Persamaan ion dari reaksi ini adalah:

Terlihat bahwa besi teroksidasi:

dan tembaga tereduksi:

Contoh-contoh lainnya
- Besi(II) teroksidasi menjadi besi(III)

- H2O2 + 2 e− → 2 OH−
Persamaan keseluruhan reaksi di atas adalah:
- 2Fe2+ + H2O2 + 2H+ → 2Fe3+ + 2H2O
- 2NO3− + 10e− + 12 H+ → N2 + 6H2O
- Besi akan teroksidasi menjadi besi(III) oksida dan oksigen akan tereduksi membentuk besi(III) oksida (umumnya dikenal sebagai perkaratan):
- 4Fe + 3O2 → 2 Fe2O3
- Pembakaran hidrokarbon, contohnya pada mesin pembakaran dalam, menghasilkan air, karbon dioksida, sebagian kecil karbon monoksida, dan energi panas. Oksidasi penuh bahan-bahan yang mengandung karbon akan menghasilkan karbon dioksida.
- Dalam kimia organik, oksidasi seselangkah (stepwise oxidation) hidrokarbon menghasilkan air, dan berturut-turut alkohol, aldehida atau keton, asam karboksilat, dan kemudian peroksida.
Reaksi redoks dalam industri
Proses utama pereduksi bijih logam untuk menghasilkan logam didiskusikan dalam artikel
peleburan.
Oksidasi digunakan dalam berbagai industri seperti pada produksi produk-produk pembersih.
Reaksi redoks juga merupakan dasar dari
sel elektrokimia.
Reaksi redoks dalam biologi
Banyak proses
biologi yang melibatkan reaksi redoks. Reaksi ini berlangsung secara simultan karena sel, sebagai tempat berlangsungnya reaksi-reaksi
biokimia, harus melangsungkan semua fungsi hidup. Agen biokimia yang mendorong terjadinya oksidasi terhadap substansi berguna dikenal dalam
ilmu pangan dan kesehatan sebagai
oksidan. Zat yang mencegah aktivitas oksidan disebut
antioksidan.
Pernapasan sel, contohnya, adalah oksidasi
glukosa (C
6H
12O
6) menjadi
CO2 dan reduksi
oksigen menjadi
air. Persamaan ringkas dari pernapasan sel adalah:
- C6H12O6 + 6 O2 → 6 CO2 + 6 H2O
- Proses pernapasan sel juga sangat bergantung pada reduksi NAD+ menjadi NADH dan reaksi baliknya (oksidasi NADH menjadu NAD+). Fotosintesis secara esensial merupakan kebalikan dari reaksi redoks pada pernapasan sel:
- 6 CO2 + 6 H2O + light energy → C6H12O6 + 6 O2
Energi biologi sering disimpan dan dilepaskan dengan menggunakan reaksi redoks.
Fotosintesis melibatkan reduksi
karbon dioksida menjadi
gula dan oksidasi
air menjadi
oksigen. Reaksi baliknya,
pernapasan, mengoksidasi gula, menghasilkan karbon dioksida dan air. Sebagai langkah antara, senyawa karbon yang direduksi digunakan untuk mereduksi
nikotinamida adenina dinukleotida (NAD
+), yang kemudian berkontribusi dalam pembentukan
gradien proton, yang akan mendorong sintesis
adenosina trifosfat (ATP) dan dijaga oleh reduksi oksigen. Pada sel-sel hewan,
mitokondria menjalankan fungsi yang sama. Lihat pula
Potensial membran.
Istilah
keadaan redoks juga sering digunakan untuk menjelaskan keseimbangan antara
NAD+/NADH dengan
NADP+/NADPH dalam sistem biologi seperti pada sel dan organ. Keadaan redoksi direfleksikan pada keseimbangan beberapa set metabolit (misalnya
laktat dan
piruvat,
beta-hidroksibutirat dan
asetoasetat) yang antarubahannya sangat bergantung pada rasio ini. Keadaan redoks yang tidak normal akan berakibat buruk, seperti
hipoksia,
guncangan (
shock), dan
seps Siklus redoks
Berbagai macam
senyawa aromatik direduksi oleh
enzim untuk membentuk senyawa
radikal bebas. Secara umum, penderma elektronnya adalah berbagai jenis
flavoenzim dan
koenzim-koenzimnya. Seketika terbentuk, radikal-radikal bebas anion ini akan mereduksi oskigen menjadi
superoksida. Reaksi bersihnya adalah oksidasi koenzim flavoenzim dan reduksi oksigen menjadi superoksida. Tingkah laku katalitik ini dijelaskan sebagai siklus redoks.
Contoh molekul-molekul yang menginduksi siklus redoks adalah
herbisida parakuat, dan
viologen dan
kuinon lainnya seperti
menadion.
[3]PDF (2.76 MiB)
Menyeimbangkan reaksi redoks
Untuk menuliskan keseluruhan reaksi elektrokimia sebuah proses redoks, diperlukan
penyeimbangan komponen-komponen dalam
reaksi setengah. Untuk reaksi dalam larutan, hal ini umumnya melibatkan penambahan ion
H+, ion
OH-,
H2O, dan elektron untuk menutupi perubahan oksidasi.
Media asam
Pada media asam, ion
H+ dan air ditambahkan pada reaksi setengah untuk menyeimbangkan keseluruhan reaksi. Sebagai contoh, ketika
mangan(II) bereaksi dengan
natrium bismutat:


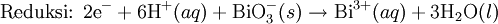
Reaksi ini diseimbangkan dengan mengatur reaksi sedemikian rupa sehingga dua setengah reaksi tersebut melibatkan jumlah elektron yang sama (yakni mengalikan reaksi oksidasi dengan jumlah elektron pada langkah reduksi, demikian juga sebaliknya).

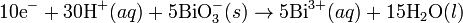
Reaksi diseimbangkan:
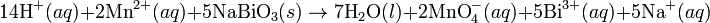
Hal yang sama juga berlaku untuk
sel bahan bakar propana di bawah kondisi asam:

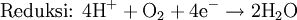
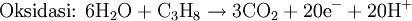
Dengan menyeimbangkan jumlah elektron yang terlibat:


Persamaan diseimbangkan:

Media basa
Pada media basa, ion
OH- dan
air ditambahkan ke reaksi setengah untuk menyeimbangkan keseluruhan reaksi.Sebagai contoh, reaksi antara
kalium permanganat dan
natrium sulfit:



Dengan menyeimbangkan jumlah elektron pada kedua reaksi setengah di atas:
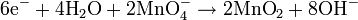

Persamaan diseimbangkan: